1 julho, 2025
Como saber o pH final do solo?
Entenda por que o objetivo da Ferticorreção não é alcançar exatamente pH 7r, mas sim buscar o equilíbrio químico, físico e biológico do sistema.
Muito se fala em atingirmos pH próximo de 7 e, quando pensamos em pH do solo entre 6 -7, logo nos vem a mente o gráfico do professor Malavolta, mostrando a disponibilidade dos nutrientes conforme o pH.
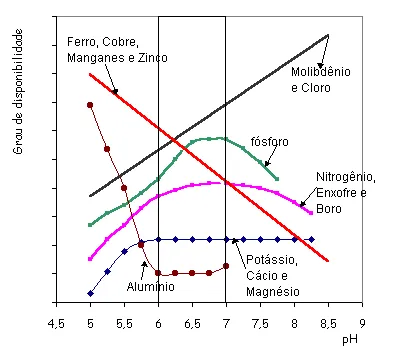
Malavolta, 1979
Mas afinal, você sabe o que quer dizer um pH 7? E porque pH 7? O que é considerado pH neutro? Muitas vezes buscamos esse “pH ideal” no solo, mas na verdade, nem sabemos o que ele quer dizer.
A escala de pH mede a concentração de íons H+ em uma solução aquosa. O termo pH significa "potencial hidrogeniônico" e é calculado pela fórmula:
pH = -log[H+]
Em condições padrão, a 25°C, a água pura passa por um processo natural chamado autoionização. Nesse processo, as moléculas de água se dissociam de forma espontânea, gerando quantidades iguais de íons hidrogênio (H+) e íons hidroxila (OH-), segundo a reação:
H₂O ⇌ H+ + OH-
As concentrações desses íons em água pura são de 1 × 10-⁷ mol/L para cada um. Como as quantidades de H+ e OH- são exatamente iguais, dizemos que a solução está em equilíbrio químico, o que caracteriza um meio neutro.
Ao calcular o pH dessa concentração de H+, temos:
pH = -log[1 × 10-⁷] = 7
Por isso, o pH 7 é o valor de referência para uma solução neutra. Valores de pH menores que 7 indicam soluções ácidas, com maior concentração de H+. Já valores de pH maiores que 7 indicam soluções básicas (ou alcalinas), com maior concentração de OH-. É importante lembrar que essa definição de neutralidade (pH = 7) vale especificamente para soluções aquosas a 25°C, já que a constante de ionização da água (Kw) varia com a temperatura.
Na água, conseguimos calcular o pH final com precisão porque estamos lidando com um meio químico simples e bem conhecido. Em soluções aquosas puras ou preparadas em laboratório, sabemos exatamente quais são os ácidos, as bases e suas respectivas concentrações. Além disso, conhecemos as constantes de dissociação (Ka e Kb) de cada substância presente, o que nos permite aplicar equações de equilíbrio químico e determinar o pH final de forma precisa.
Já no solo, a situação é muito diferente. O solo é um sistema extremamente complexo e heterogêneo, composto por uma mistura de fases sólida, líquida e gasosa, além de conter uma grande variedade de componentes químicos. Ele abriga inúmeros pares ácido-base, como ácidos orgânicos, ácidos húmicos, óxidos e hidróxidos de metais como alumínio e ferro, além de sais correspondentes e outros compostos. O grande problema é que não conhecemos com exatidão todos esses componentes, suas concentrações e suas constantes de equilíbrio.
Essa falta de informações detalhadas impossibilita a realização de um cálculo teórico exato do pH final do solo. Além disso, muitas das reações que influenciam o pH ocorrem na fase sólida, com processos de adsorção, dessorção e troca de íons, que são lentos e difíceis de quantificar. O solo também apresenta uma elevada capacidade de tamponamento, o que significa que ele resiste a variações bruscas de pH, complicando ainda mais qualquer tentativa de previsão matemática. A capacidade de tamponamento do solo também se dá pela presença das substâncias anfóteras.
São substâncias que podem se comportar tanto como ácidos quanto como bases, dependendo das condições do meio. Ou seja, elas têm a capacidade de:
- Doar prótons (H+) → atuando como ácido
- Receber prótons (H+) → atuando como base
No solo, substâncias anfóteras estão principalmente associadas aos óxidos e hidróxidos de metais como alumínio (Al) e ferro (Fe). Esses elementos fazem parte da fração mineral do solo e têm um papel importante no tamponamento do pH.
Dependendo do pH inicial do solo:
- Em solos ácidos (pH baixo):
As substâncias anfóteras podem reagir como bases, neutralizando o excesso de H+. Por exemplo, o alumínio pode reagir formando espécies como Al(OH)²+ ou Al(OH)₃, retirando H+ da solução. - Em solos alcalinos (pH alto):
As mesmas substâncias anfóteras podem reagir como ácidos, liberando H+ e ajudando a reduzir o pH. O alumínio, por exemplo, pode hidrolisar e liberar H+.
Por isso, é impossível saber com precisa exatidão qual o pH final do solo, mas é possível calcularmos quanto de acidez estamos gerando e quantas hidroxilas necessitamos aportar para equilibrar o pH. Saiba como no link abaixo
https://ferticorrecao.com.br/acidificacao-do-solo-por-adubos-nitrogenados e https://ferticorrecao.com.br/principais-fontes-de-geracao-de-acidez
Snão devemos buscar cegamente um pH 7 no solo. A ferticorreção não é apenas uma busca por um número específico de pH, mas sim um processo de ajuste que visa o equilíbrio do sistema como um todo, levando em conta os aspectos químicos, físicos e biológicos do solo.
Cada solo tem suas particularidades, sua mineralogia, sua textura, sua biologia e suas necessidades nutricionais. O objetivo da Ferticorreção é criar condições para que o solo seja mais fértil, mais produtivo e mais equilibrado, respeitando sua natureza e seu funcionamento. O pH ideal, portanto, é aquele que favorece o melhor desenvolvimento das plantas e a maior eficiência de uso dos nutrientes, dentro das condições específicas de cada sistema de produção.
Continue lendo nosso blog
Ficou com alguma dúvida?
Entre em contato pelo formulário abaixo.